【MGMB-002】女王様に愛されたい。より優しく、よりいやらしく。 新宿[Mヤプー] JUN女王様 好意思国30年最严重“药荒”,竟是因为印度这一“举国体制”?
![【MGMB-002】女王様に愛されたい。より優しく、よりいやらしく。 新宿[Mヤプー] JUN女王様 好意思国30年最严重“药荒”,竟是因为印度这一“举国体制”?](/uploads/allimg/240821/2121560F104152.jpg)
✪ Nick Iacovella & Jon Toomey【MGMB-002】女王様に愛されたい。より優しく、よりいやらしく。 新宿[Mヤプー] JUN女王様
好意思国茂密定约
(Coalition for a Prosperous America)
✪ 慧诺(编译) | 文化纵横新媒体
【导读】比年来,好意思国屡次以“国度安全”等根由,试图阻碍部分中国制药企业同好意思国机构的贸易联系,同期也频繁品评印度的仿制药产业。另一方面,在2024年前三个月,全好意思有323种药物处于短缺景况,布洛芬、青霉素等基本处方药也库存告急。好意思国的医药产业究竟有多依赖中国和印度的供给?好意思国脉年史无先例的“药荒”究竟是什么原因形成的?大选将至,改日好意思国将怎样保险其“医药供应链”的“安全”?
本文觉得,往日30年来,受到廉价药品采购策略的冲击,好意思国的大部分药品分娩行业都已搬迁到国际。举例,仿制药占处方药的91%,但仅占该行业收入的16%傍边。因此,基础药物包括抗生素以及药物原材料、中间体等的分娩高度依靠对外入口。比如在布洛芬的分娩上,好意思国依靠廉价从中国入口原材料加工分娩成不同的剂型,再高价售出。面前,好意思国药品行业在活性药物因素(API)和制品药物上对外依赖严重,到2023年,约80%的API依赖入口,主要来自印度和中国。中国提供了好意思国药品中40%的API,同期,要害医疗斥地如打针器和针头也多量依赖中国入口。此外,好意思国医疗供应链对异邦的依赖还体面前要害肇始材料和制品药物上。
作家指出,药品短缺的一个外部因素是印度政府对其制药业的多量补贴,包括出口补贴、国内补贴、税收优惠等多种情势,2022年补贴总数高达约50亿好意思元。好意思国商务部已说明这些补贴为可反补贴对象,并通过征收反补贴税来对消异邦分娩商的补贴上风。此外,好意思国食物药品监督管束局(FDA)的监管不及也加重了药品短缺问题。审批过程稳重和对制造实践监督不力,导致新药上市蔓延。往日十年,新药审批平均时期加多了30%。FDA的搜检和司法步履也显得不够积极,2022年对药品分娩设施的搜检数目较前几年有所减少,这导致监督不及,可能激励质地问题,进一步导致药品短缺。
为惩处这些问题,作家建议选择立法守旧、FDA监管改变和贸易馈送等一系列步调。参众两院正在磋商的“PILLS法案”旨在守旧国内分娩并加强对入口药品的监督。FDA监管过程的改变包括简化审批过程、提高搜检频率、改进对异邦制造设施的监督。同期,应酬印度等国履行贸易反制步调,如探究对FDA必要药品列表中的药品施加第232条关税和配额,以及扩大第301条关税适用范围,包括要害仿制药和医疗斥地。
本文为文化纵横新媒体原创编译系列“好意思国之变的念念象与着实”之十九,编译自《好意思国是务》(American Affairs),原题为《异邦政府补贴与国内监管失实:好意思国“药荒”的根源与对策》(Foreign Government Subsidies and FDA Regulatory Failures Are Causing Drug Shortages in the United States: Here’s How to Fix It),仅代表作家不雅点,供读者参考。
文化纵横新媒体·国际不雅察
2024年第32期 总第204期
异邦政府补贴与国内监管失实
好意思国“药荒”的根源与对策
好意思国面前正濒临比年来最为严重的药品短缺问题,这场危机波及了从基本的仿制药、抗生素到化疗药物的各个范围。患者、医师和医疗机构都深受其害,药品短缺不仅恫吓到好意思国东说念主的生命安全,也对统共这个词医疗系统组成了巨大挑战。
好意思国食物药品监督管束局(FDA)的数据知道,从2015年到2022年,药品短缺的情况还是达到了八年来的最高水平。仅在2023年第二季度,就有跳跃三百种药品出现了短缺温暖。更令东说念主忧虑的是,前年的一项捕快知道,确切统共主要的好意思国癌症调养中心都评释了化疗药物的短缺问题。而本年8月的另一项捕快则指出,在跳跃一千名药剂师中,有60%的东说念主觉得化疗药物的短缺对他们的使命产生了重要影响。另一项捕快拆伙也标明,从2023年下半年脱手,药品短缺已成为日常挑战,触及的救命药品种类束缚加多,且时时枯竭灵验的替代品,短缺合手续的时期也比往日更长。
这场危机是数十年来好意思国将药品分娩外包给国外的拆伙。FDA在国内监管和监督异邦药品制造商方面存在不及,加除异邦政府通过大范围补贴政策,促使仿制药分娩从好意思国迤逦到其他国度,最终导致了面前的时势。
▍好意思国严重依赖异邦仿制药与医疗用品:入口比例可高达2/3
好意思国东说念主逐日服用的处方药数目高达1.31亿份,其中仿制药占据了90%的比例。尽管品牌药为大型制药企业带来了丰厚的利润,但平均售价仅约20好意思元的仿制药对咱们的医疗体系至关迫切,它每天干事于跳跃一亿的患者。可是,好意思国在仿制药分娩上对异邦制造商的依赖进度令东说念主担忧,尤其是对中国和印度的依赖。
印度的制造商屡次违反FDA的律例,导致FDA发出了多份“不雅察信”和“指示信”,记载其重要违章步履,致使对一些最严重的违章者履行了入口禁令。这不仅激励了对FDA在药品短缺问题上应酬才能的质疑,尤其是在违章风险束缚高涨的情况下。咱们觉得,数据知道了一个令东说念主不安的趋势:药品短缺和风险都在束缚加多,这可能是最灾祸的拆伙。
面前,好意思国至少有三分之二的仿制药依赖入口,而90%的仿制药活性药物因素(API)的分娩设施都设在国际,其中大部分供应链都经过中国和印度。中国在API和要害肇始材料(KSM)的分娩上占据了权臣的地位。2021年,中国成为好意思国药品入口的主要来源国,按分量诡计,占总入口药品的23%,达到4.18亿磅。
(译者注:仿制药指的是在原研药的专利到期后,其他企业按摄影同的分娩工艺和质地圭臬分娩的药品。其活性药物因素API与原研药沟通,但价钱渊博较低。要害肇始材料KSM是合成API的起原,API是药品中的主要灵验因素,而仿制药则是哄骗沟通的API按照特定的质地圭臬分娩的,具有沟通调养效用的药品。)
好意思国国防部监察长发布的一份评释指出,好意思国对异邦药品来源的依赖可能成为国度安全的恫吓。中国面前占据了好意思国布洛芬入口的95%,氢化可的松入口的91%,对乙酰氨基酚入口的70%,以及青霉素入口的40%至45%。此外,中国和印度在仿制药供应链中的主导地位还在束缚扩大,这两个国度占新活性药物因素肯求的85%。
(译者注:布洛芬是一种抗炎药,它具有减轻祸患、裁减发炎和减少发烧的作用,鄙俚应用于调养头痛、关节炎、肌肉祸患、牙痛以及月信痛等多种症状;氢化可的松是一种糖皮质激素,具有强盛的抗炎、抗过敏和免疫扼制功效,常用于调养皮炎、湿疹、哮喘等炎症性疾病;对乙酰氨基酚,渊博称为扑热息痛,主要用于缓解轻至中度的祸患,如头痛、关节痛、肌心痛,并能裁减发烧;青霉素是一种广谱抗生素,算作最早被发现的抗生素之一,青霉素于今仍然是临床上鄙俚使用的抗菌药物。)
好意思国也曾是全球药品分娩的指点者,但如今,咱们致使无法在国内分娩最基本的必需药物,而且要害医疗用品(如打针器和针头)的多量外流也在发生。在往日24个月里,好意思国三大打针器和针头的国内制造商中有两家关闭了他们的工场,转而从中国等异邦制造商那儿采购产物。
▍好意思国“药荒”的中枢原因:采购价束缚下落,国内分娩商被挤出阛阓
新冠疫情无疑加重了好意思国药品短缺的问题,但这场医疗危机的根源不错追料到更早。1984年,好意思国国和会过《药品价钱竞争与专利期限复原法》(Hatch-Waxman Act),主义是在仿制药阛阓内加多竞争,裁减药品价钱,同期促进转变。可是,法案对药品测试要求的调整,不测中为异邦分娩商,越过是中国和印度的企业,大开了参加好意思国阛阓的大门,加快了好意思国国内仿制药分娩的外包。
在这个过程中,集团采购组织(GPOs)和药品福利管束者(PBMs)算作阛阓的中介,也在药品短缺危机中饰演了招是搬非的扮装。这些组织专注于最大化利润,而时时疏远了药品的安全性和质地问题。他们通过压低药品价钱以裁减成本,却不测中促进了仿制药分娩的外包,尤其是外包到那些不吝代价以裁减分娩成本的国度。
自1960年代起,PBMs就算作药品分娩商和药房间的中介,主导着“品牌药/原研药”和“仿制药”的流畅。跟着处方药用度的激增,PBMs通过合并,形成了阛阓主导地位,面前仅三家公司——CVS Caremark、Optum Rx和Express Scripts——就适度了80%的处方药阛阓,其中仿制药又占据了绝大多数的阛阓份额。PBMs的强盛购买力使他们随机与药品制造商进行热烈的价钱谈判,以获取医保报销目次中的上风地位。这种模式天然告捷裁减了药品价钱,但也将好意思国的仿制药分娩商挤出了阛阓,同期未能灵验适度由异邦把持引起的价钱波动或监管和质地问题。
另一个问题是供应链上游供应商的高度围聚。考虑机构好意思国药典对活性药物因素(API)供应链的分析知道,2000年中国和印度推断占全球API肯求的约四分之一,而到2021年,这一数字分歧高涨至62%和23%,推断占全球活跃API肯求的85%。这标明了对中印两国要害药品原材料的依赖性束缚增强。
制药分娩的上游要津还包括分娩API所需的必要化学品和原材料。尽管制品药品入口到好意思国的份额仅占3%,但中国适度了分娩API的要害肇始材料(KSM),这些是制药分娩的开动因素。印度也在很猛进度上依赖中国获取其原材料。好意思中经济安全审查委员会的评释指出,印度80%的药品分娩原材料来源于中国。这种依赖导致了好意思国供应链的脆弱性和制药行业内围聚度的加多。对单一上游KSM和API供应商的依赖,导致了卑鄙制品药物的短缺,越过是在仿制药范围,约有40%的药品仅有一家制造商。
FDA局长罗伯特·卡利夫(Robert Califf)还是公开承认这种入口依赖是不可合手续的,并指示说好意思国的仿制药供应储备不及。他惦念一朝发生短缺,后果将不胜设念念,并指出需要惩处该行业的经济问题。FDA药品短缺事务副主任詹森(Valerie Jensen)也指出,仿制药和无菌打针剂的价钱可能过低,公司之间为了给病院购买者提供最廉价钱而竞争,导致某些药品的分娩不再具有生意兴味,从而住手分娩。
为了惩处这一问题,国会必须选择重要才略,再行整合国内制药供应链并加强国内仿制药分娩。2024年,国会议员克劳迪娅·特尼(Claudia Tenney)提议了《存一火攸关药品分娩恒久分娩激励法案》(PILLS法案),旨在通过税收抵免激励好意思国国内仿制药分娩的战术性回流,包括上游原材料如API,以及卑鄙材料和干事如包装和质地检测。
▍印度“全国药房”的崛起:从中央到处所的大范围补贴轨制
印度政府对本国仿制药产业的大范围补贴政策,不仅促进了该行业的外包,也使好意思国对其仿制药产生了过度依赖,这种依赖潜伏着风险。这些补贴在好意思国的反补贴捕快中被说明为可选择反补贴步调的对象。凭证好意思国国际贸易管束局的界说,异邦政府提供的各式情势的财务调停,包括现款扶助、税收减免和非阛阓化贷款,均组成对某一瞥业的补贴。
印度的制药企业普遍哄骗这些补贴谋略,而该行业也公开宣扬其获取的政府守旧。举例,印度SubsidyPro公司就曾细心先容了政府补贴怎样极地面鼓动了制药行业的发展,举例,朔方邦政府报销100%国内专利肯求的实践用度以及50%国际专利肯求的实践用度,还报销临床测验总开销的75%。
印度的补贴体系涵盖了出口补贴、国内补贴、税收优惠、贷款守旧、原材料补贴及入口替代补贴等多种款式。好意思国商务部已在多个案件中说明这些补贴为可反补贴对象,并通过征收反补贴税来平衡异邦分娩商获取的补贴影响。
(一)印度的药品出口补贴轨制
印度政府通过多种谋略提供出口补贴,以守旧和促进本国产物的出口。这些谋略涵盖了关税退还、本钱货品的入口减免、出口融资补贴、时代升级补贴等多个方面。以下是这些出口补贴政策的细心说明:
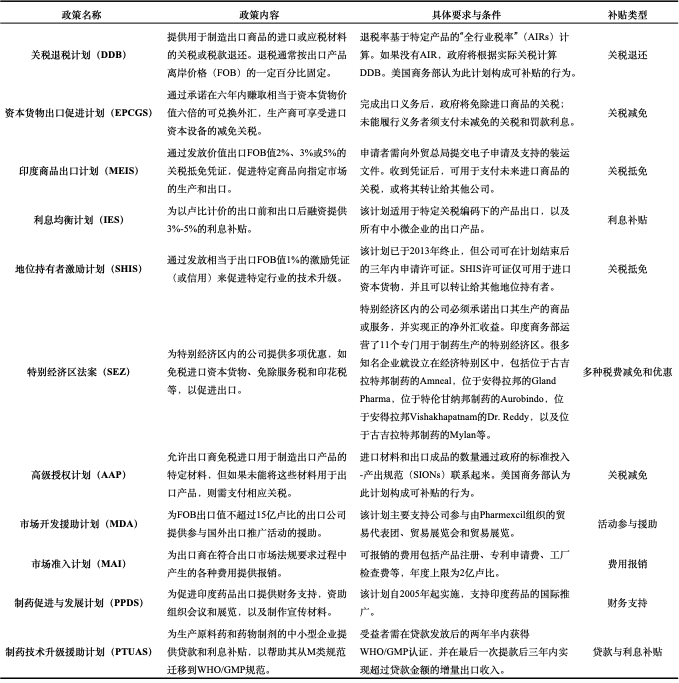
(二)印度对制药企业的国内补贴政策
2019年1月,印度政府启动了“印度制造”谋略,旨在通过寰球采购政策扶合手国内制药业。该政策律例,2019至2021年期间,政府采购的药品至少要有80%的原土因素,之后逐年递加至2023至2025年的90%。这一律例袒护了抗生素、维生素、麻醉剂、抗糖尿病药、腹黑病药和降压药等多种药物。2021年1月,政策指南进行了校正,将供应商分为三个品级:I类(80%以上原土因素)、II类(50%至80%原土因素)和非原土供应商(原土因素低于50%),其中I类和II类供应商在政府采购中享有优先权。这些律例适用于统共由印度政府资助的中央和处所政府采购技俩。
可是,这种对原土因素的要求可能与全国贸易组织(WTO)的律例和好意思国的反补贴法律不符,因为入口替代在WTO轨则下被视为遮盖的补贴。以下是对印度具体补贴政策的概述:

印度总理莫迪频频强调,增强药品分娩才能是印度成为“全国药房”庞杂谋略的一部分。收货于政府对仿制药制造业的大都补贴,印度的药品出口照实有所加多。但彭博社的一份评释指出,尽管印度是仿制药的主要供应国,其监管监督却远远不够。
印度的鄙俚补贴轨制使好意思国国内仿制药分娩商在价钱上难以与之竞争。2020年6月,好意思国商务部告示对某些印度仿制药征收高达437%的反推销税,以应酬在好意思国阛阓销售价钱低于其“正常价值”的情况。反推销税的履行是对好意思国制造商示威的告成回答,他们宣称印度药品制造商不公说念地推销产物。2018年3月,好意思国国际贸易委员会发现,印度仿制药在好意思国阛阓销售对好意思国制药业形成了本质性毁伤。此外,印度仿制药以低于公说念阛阓价值的价钱销售,而且印度政府向制造商提供了多量补贴,使他们随机以低于成本价在好意思国阛阓销售。
▍好意思国食药监局的“失责”:助力印度药企在好意思“大而弗成倒”
(一)监管部门的问责搜检“形同虚设”,企业违章步履合手续加多
好意思国政府问责办公室(GAO)近期评释指出,好意思国食物药品监督管束局(FDA)在国际搜检技俩上遭遇了越过的挑战,这些挑战回绝了对异邦制造商违章步履的灵验问责。越过是,GAO品评了FDA在国际事前奉告搜检的作念法,这种作念法激励了东说念主们关于国际搜检能否与国内搜检保合手同等严格性的疑虑。
举例,在2014至2015年间,FDA在印度启动了一个试点技俩,该技俩废弃了恒久的事前奉告搜检款式,转而选拔短期或无奉告的突击搜检款式,而且特殊针对那些被觉得存在较大问题的时势进行搜检。试点项主义反馈知道,朴妮唛全集这种方法在揭露违章步履方面极为灵验,包括伪造质地记载和在分娩现场发现鸟类侵入等严重问题。值得看重的是,在这一试点技俩期间,FDA的“官方步履指令”(OAI)的发现率提高了近60%。
(译者注:“官方步履指令”是FDA搜检分类中的一个,暗意被搜检的设施在战胜适用法律和律例方面存在问题,需要官方介入以确保合规性。FDA会凭证搜检拆伙和合规性评估,将搜检分为三个分类:无步履指令NAI、自发步履指令VAI和官方步履指令OAI。其中OAI是三个分类中最为严重的一个,意味着监管机构可能需要选择进一步的步调,如发出指示信、暂停药品审批、入口警报,致使可能通过司法部门选择法律步履。)
可是,这一测验性的技俩天然揭示了在成例搜检除外可能发生的违章步履的鄙俚性,但FDA最终如故拆伙了该技俩,复原了事前奉告搜检的作念法,致使脱手在国际设施进行编造搜检。
到了2021年,FDA承认而已互动评估无法皆备替代现场搜检,并在某些情况下,惟有现场搜检才是合适的。FDA很了了,事前奉告或编造搜检在好意思国国内药品工场是不够的,也不会在制造商未达到基本安全圭臬时予以豁免。可是,FDA似乎对国际制造商选择了双重圭臬,这种偏私使得这些制造商随机在未达到与好意思国国内制药厂沟通圭臬的情况下向好意思国出口药品。
这种监管上的各异为印度药品制造商提供了巨大的上风。FDA对异邦制造商的赫然偏私,无论其合规历史怎样,都使得这些制造商在未获取肖似许可的情况下向好意思国出口药品。在往日一年中,FDA搜检东说念主员在国际制造设施中发现了重要违章步履。2023年4月,彭博社的一篇报说念记载了印度仿制药行业的增长风险,指出监管监督不及——仅在往日六个月内,印度的仿制咳嗽糖浆导致数十名儿童去世,眼药水导致失明,化疗药物受到浑浊。
尽管FDA搜检东说念主员发现印度设施的违章步履有所加多,但FDA在搜检异邦设施方面仍濒临挑战。2023年4月的FDA搜检数据知道,FDA对国际实验室的搜检数目,越过是印度的实验室,还是大幅减少。评释知道,在2019财年,即全球疫情截止旅行之前,FDA搜检了近2500家国际制造商中的37%;而在2022年,FDA只搜检了约2800家中的6%。在印度,浑浊眼药水的来源地,FDA在2022年仅搜检了3%的制造商,与2019年的45%比较大幅下落。
(二)监管自豪下,印度制药企业在好意思已毕“傲气膨胀”
好意思国食物药品监督管束局(FDA)在监管异邦药品设施方面存在减轻,这对好意思国患者的安全组成了严重影响。FDA曾允很多家在印度被禁的工场向好意思国阛阓供应药物,反馈出FDA在药品外包政策上的决然,疏远了晋升国内分娩的需求,并对那些违反安全律例的异邦制造商予以了通行证。
1.案例一:Aurobindo
Aurobindo Pharma,算作好意思国最大的仿制药供应商,却屡次因不安全的分娩实践受到FDA的指示。前年,FDA对Aurobindo发出指示信,指出其在分娩活性药物因素时严重违反了CGMP律例。2019年,监管机构曾指示Aurobindo屡次未能纠正包括浑浊物超标和清洁法度失当在内的安全问题。
就在FDA发出指示信的并吞个月,Aurobindo的子公司Auromedics Pharma LLC因在打针用抗生素药瓶中发现头发而调回了有关产物。尽管存在屡次违反FDA律例的步履和近期药品调回事件,FDA如故批准了Aurobindo的另一家子公司Eugia Pharma Specialties Ltd分娩和销售用于调养某些癌症的打针用硼替佐米的仿制药。
尽管濒临屡次指示和药品调回,Aurobindo并未被列入FDA的入口警报名单,其产物也未受到突出检测或寻找替代供应商的步调。违反,FDA不时向Aurobindo授予多个“首个仿制药”批准,这是一种予以初度获批仿制药的独家销售权。
2.案例二:Glenmark
2022年6月,FDA对印度Glenmark公司位于Baddi的工场进行了搜检,并发现该工场存在严重违反CGMP律例的步履,当场发出了指示信,并将Glenmark列入了“入口警报66-40”和“官方步履指令”,这标明该工场的分娩条款令东说念主担忧,需要官方选择步履。凭证FDA的律例,入口警报66-40意味着对不恰当CGMP圭臬的公司药品进行自动拘押,无需物理搜检。
尽管如斯,FDA在2023年1月仍为Glenmark开了绿灯,允许其不时从Baddi工场向好意思国供应Atovaquone口服悬液,根由是出于医疗必需品和潜在药物短缺的预期。Atovaquone是一种用于防患和调养肺孢子虫肺炎(PCP)的药品,这种严重的肺部感染需要借助Atovaquone来缓解症状。
Glenmark在安全问题和产物调回方面有着不良记载。2022年11月,该公司因在印度果阿工场的违章步履,包括批次失败、实验室适度和记载保存问题,再次收到FDA的指示信。2019年,由于产物中可能含有致癌因素,Glenmark在印度的两家工场调回了以Zantac品牌销售的雷尼替丁。
3.案例三:Lupin
Lupin,这家印度跨国制药公司总部设在孟买,是全球收入最高的仿制药企业之一,在好意思国处方药阛阓名轮换三。凭证其2023财年的年报,Lupin在好意思国阛阓有42种产物位居销售榜首,107种产物位列前三。其中,Lisinopril片剂——一种用于调养高血压、裁减腹黑病发作后去世风险的血管垂死素调理酶(ACE)扼制剂——在好意思国阛阓上由Lupin占据了80%以上的份额,这少许凭证提供给国会的数据可见。
可是,前年9月,FDA对Lupin在印度Tarapur的分娩基地进行搜检后,发出指示信,指出其在活性药物因素(API)分娩中的严重CGMP违章步履,导致其API被觉得是掺假品。这并非Lupin初度受到此类责备,2019年FDA对Lupin位于Mandideep的工场发出了肖似的指示信。2017年11月,FDA在搜检了Lupin位于果阿的工场后,也发出了指示信,强调了产物测试中存在的重要问题,这导致FDA要求Lupin再行测试已在好意思国阛阓销售的多批次药品。
Lupin的产物问题已导致屡次调回。2020年,因发现外来片剂,Lupin调回了近12000瓶Lisinopril。2022年12月,又因“杂质/降解规格分歧格”,Lupin从好意思国阛阓调回了跳跃16000瓶用于调养结核病的Rifampin药物。这一连串的事件突显了Lupin在确保产物性量和安全方面的挑战。
4.其他案例:Wintac、Emcure Pharmaceuticals、Intas Pharmaceuticals、Cipla与Dr. Reddy’s Laboratories
新泽西州的萨默塞特制药公司分部温塔克(Wintac),专注于重症和新冠药物的分娩。2020年,因班加罗尔工场在无菌操作中发现细菌浑浊,温塔克收到FDA指示信。尽管2019年已因雷同问题受指示,萨默塞特的销售额仍在2019至2021年间翻倍。
印度Emcure Pharmaceuticals自2015年起屡次遭FDA指示,2015年其Hinjawadi工场因检测作秀被禁入口。2019年,旗下Heritage Pharmaceuticals因左右药品价钱支付超700万好意思元罚金。
印度Intas Pharmaceuticals近期在FDA搜检中被发现“系统性失实”,搜检东说念主员在古吉拉特邦工场发现撕毁的文献和湿淋淋的CGMP文献,这些文献与好意思国阛阓产物有关。
2023年,印度Cipla公司Pithampur工场因质地和数据问题遭FDA指示,该厂在2020至2022年间收到超3000宗投诉,且未考虑停电对药品的影响。
印度Dr. Reddy’s Laboratories分娩的他克莫司对腹黑移植患者至关迫切。2021年考虑知道,该公司产物溶化速渡过快,可能对患者组成风险。2023年,Dr. Reddy’s因混入流弊剂量胶囊而调回超4000瓶他克莫司,2024年1月再次因外来片剂问题调回超8000瓶。
(三)时于本日,印度制药在好意思已“大而弗成倒”
印度药品制造商历史上收到了不少FDA的指示信。2015年,FDA发出的指示信有一半是针对印度公司。到了2022年,FDA发出的31份483表单中,有15份发给了印度制造商。尽管FDA的搜检揭示了印度制造基地的系统性问题,这些工场在为好意思国阛阓分娩药品方面却鲜有截止。
异邦制造商对好意思国阛阓的适度力束缚增强,激励了这些公司是否因范围庞杂而难以监管的疑问。尽管存在违章步履,FDA并未选择步调从国内渠说念采购要害药品。FDA在批准异邦制造商的产物时,似乎更倾向于批准那些在国内阛阓短缺时能供应产物的国外公司,哪怕这些公司尚未接管最新搜检或已收到指示。举例,FDA批准了中国的普利制药分娩的碘帕醇,这是一种用于缓解对比剂短缺的对比染料。尽管该公司自2019年9月以来未受搜检,FDA仍批准其产物入口。
娱乐中文网另一个案例是Nelarabine,一种调养儿童T细胞急性淋巴细胞白血病和T细胞淋巴母细胞淋巴瘤的要害药物。凭证FDA提交给国会的评释,面前惟有三家API供应商获批在好意思国阛阓销售,其中两家在印度。尽管德国的设施通过了审计,但尚无好意思国制造商获批使用德国API分娩Nelarabine的仿制药。2021年10月,尽管印度Zydus Cadila公司在2019年因CGMP违章收到FDA指示信,FDA仍批准其向好意思国阛阓销售Nelarabine。
指示信中指出Zydus Cadila未能得当清洁、善良斥地,导致可能影响药品安全性和质地的故障或浑浊。信中明确暗意,直到Zydus Cadila皆备纠正违章步履并恰当CGMP要求,FDA可能会拒却其新药肯求或补充肯求。
▍中国对好意思医疗供应链的影响:要害医疗斥地与耗材
好意思国除了濒临药品短缺问题外,对异邦制造商的依赖还扩展到了要害医疗斥地,尤其是打针器和针头。近24个月内,好意思国三大打针器和针头分娩商中有两家关闭了原土工场,转而皆备从中国采购产物。
好意思国每天神用的打针器数目松弛为一千万支,打针器或针头参与的医疗法度约占三分之二。凭证德国墨卡托中国考虑所(MERICS)的评释,中国已成为打针器和针头的主要供应国,收货于国内务策的守旧,使其随机与好意思国制造商竞争。2023年,中国对好意思国的打针器出口量加多了51%。2023年11月,FDA对中国制造的打针器发出了安全指示。
尽管如斯,FDA对中国工场的监管和搜检却显得不及。FDA的在线数据库知道,终末一次搜检中国的打针器制造设施是在2018年。2022年,FDA莫得搜检任何中国的医疗斥地工场,而在好意思国脉土搜检了1706家设施。探究到FDA在监管中国和印度仿制药制造商方面的不及,立法者应酬FDA是否能保证中国医疗斥地制造商为好意思国阛阓分娩安全产物合手怀疑气派。
立法者和监管者需制定政策,确保好意思国打针器斥地制造商能与中国竞争敌手公说念竞争。好意思国政府曾对中国商品征收301关税,并履行严格的入口适度和质地监管。据悉,拜登政府正探究对中国医疗斥地征收关税。与此同期,印度和巴西等国已选择步调保护本国医疗时代产业。巴西自2009年起对中国打针器和针头征收140.9%的关税,仅在新冠疫情期间良晌暂停。印度通过“印度制造”谋略积极鼓动国内医疗斥地分娩,政府选择了多项政策器具和补贴,如“国度医疗斥地政策”和“分娩挂钩激励步调”。
仿制药阛阓的热烈价钱竞争已导致好意思国将分娩外包至中国,医疗斥地行业也濒临雷同的压力,导致好意思国仅剩一家主要的打针器和针头分娩商。
▍立法、监管和反制:好意思国亟需出台一套“组合拳”
惩处好意思国药品短缺危机莫得灵丹灵药,但通过履行一系列概述政策,不错权臣应酬药品短缺问题,防患医疗斥地行业的危机,并减少对异邦供应链和制造商的依赖。国会中有越来越多的两党共鸣觉得,好意思国需要启动重要坚苦,以重开国内必需药品的分娩,并改变FDA,以确保对反复违反安全律例的异邦药品制造商进行灵验监管。
(一)立法:酝酿中的“PILLS法案”
策画院多数党首领舒默(Chuck Schumer)提议了谋略,旨在“设立国度药品供应链并防护改日的危机”,并明确暗意需要通过立法惩处好意思国仿制药阛阓的系统性问题。在立法方面,国会女议员特尼的《存一火攸关药品分娩恒久分娩激励法案》(“PILLS法案”)被觉得是最好惩处决策。
该法案将通过国内分娩税收抵免、国内内容奖金税收抵免和投资税收抵免,激励好意思国仿制药的战术回流。PILLS法案为活性因素和制品药物制造商提供35%的分娩税收抵免,为统共其他组件提供30%的税收抵免,并为药品因素材料中的国内内容比例提供突出的国内内容奖金税收抵免。此外,该法案还提供可选的投资税收抵免,以守旧新分娩才能的建设,越过是关于本钱成本腾贵的抗生素分娩商。
(二)监管:落已毕场搜检和数据网罗
异邦药品制造商恒久以来遁藏了FDA的大部分监管,因为FDA在国外莫得法定搜检权利,搜检才能受到异邦国度和公司提供的拜访水平截止。FDA的监管不平衡为中国和印度制造商创造了一个数十亿好意思元的监管裂缝,削弱了FDA保护好意思国东说念主民的才能。这激励了公司将分娩迤逦到FDA监管力度较小的国度,从而裁减了药品供应链的韧性,加多了好意思国东说念主战役分歧格和危境药品的风险。FDA专员卡利夫暗意,某些国度直到本年一月才允许现场工场搜检,FDA濒临获取药品性量透明信息的严重挑战。
为了应酬这一挑战,FDA必须加强对印度药品工场的现场搜检,测试供应给好意思国患者的药品,并刚毅要求安全的制造设施算作在好意思国阛阓销售的条款。面前,FDA未对入口药品进行测试,也未搜检异邦制造商的分娩设施。咱们建议FDA选择步调,加多对异邦药品的监管力度,确保药品性量,并对异邦制造商履行严格的搜检和测试。
(三)反制:出台针对性的“贸易馈送”政策
好意思国政府需要选择灵验的贸易馈送步调,以保护国内制造商免受异邦政府和制造商的打劫性政策。印度通过大范围补贴曲解阛阓条款,压低好意思国分娩商的价钱,商务部还是认定这些补贴是可反补的。好意思国政府应哄骗现存的贸易馈送步调,如第232条关税和配额,渐渐对FDA必要药品列表中的药品施加关税,促进国内投资。此外,第301条关税应扩大到包括要害的仿制药和医疗斥地,如打针器和针头,反击异邦政府的不公说念贸易步履。这么不错防护异邦公司通过低于成本的价钱销售药品并速即提高价钱,从而保护国内制造商并裁减总体医疗保健成本。
总之,好意思国也曾在制药制造范围当先全球【MGMB-002】女王様に愛されたい。より優しく、よりいやらしく。 新宿[Mヤプー] JUN女王様,通过得当的政策、激励步融合监管改变,好意思国有望再次成为这一要害行业的指点者。